去泛素化酶: 蛋白质降解的“阻碍者”
类型:技术文章 时间:2021-07-05
泛素化和去泛素化是机体中调控蛋白质降解的重要分子机制。去泛素化酶(DUBs),是一类数量很大的蛋白酶类家族,目前认为是肿瘤、神经退行性疾病等许多重大疾病的重要药物靶标。
泛素化是一种细胞内的蛋白质标记系统,它会给需要降解的蛋白质打上泛素标签,而细胞内的蛋白酶体会识别这些标签,将其降解。去泛素化酶(deubiquitinating enzymes, DUB)则扮演“阻碍”的角色,破坏这些标签的形成,或将打上的标签进行水解,从而使蛋白质稳定表达(图1)[1]。泛素化酶与去泛素化酶协同形成了独特的泛素网络,共同参与细胞生命过程的调控。
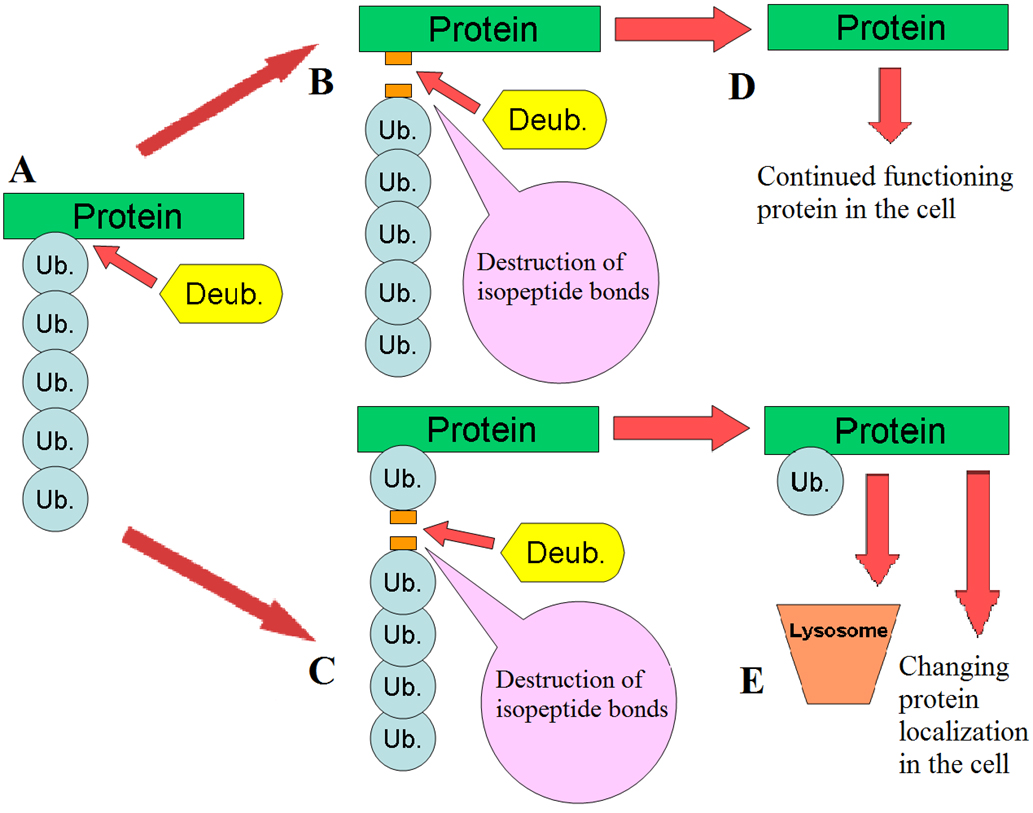
图1:泛素化与去泛素化调控[1]
去泛素化酶
去泛素化酶是一类数量很大的蛋白酶类家族,人类基因组编码近100种去泛素酶,可分为两大类:半胱氨酸蛋白酶家族和金属蛋白酶家族。半胱氨酸蛋白酶家族包含一些泛素特异型加工蛋白酶(USPs),泛素羧基末端水解酶(UCHs),Machado-Josephin结构域蛋白酶(MJDS)和卵巢肿瘤相关蛋白酶(OTU)。金属蛋白酶家族只包含MPN(+)/JAMM蛋白酶家族。
去泛素化酶主要通过水解泛素羧基末端的酯键、肽键或异肽键,将泛素分子特异性地从链接有泛素的蛋白质或者前体蛋白水解下来[2]。去泛素化酶具有以下功能:1)维持游离泛素水平,即将泛素分子从泛素化的蛋白底物上游离出来;2)从任何泛素介导的降解途径(蛋白酶体、内泌体和自噬体)中解离蛋白质,防止其降解;3)控制泛素介导的后续生理活动的启动[3]。
图2:去泛素化酶的功能[3]
去泛素化酶作用机制
去泛素化酶是作用于泛素分子之间或泛素与被修饰蛋白质之间的肽键或异肽键的蛋白酶,其作用机制为:(a)加工泛素前体蛋白,促进泛素蛋白的成熟;(b)对蛋白质底物的特异性识别,去除泛素-蛋白的结合,水解泛素与被修饰蛋白之间的肽键或异肽键;(c)去除非降解途径中产生的泛素-蛋白非特异性结合;(d)回收从降解的靶蛋白上脱落的泛素分子;(e)对泛素链的特异性识别并对泛素分子之间的肽键或异肽键进行切割;(f)特异性去除底物单泛素化(图3)[4]。

图3:去泛素化酶的作用机制[4]
去泛素化酶抑制剂
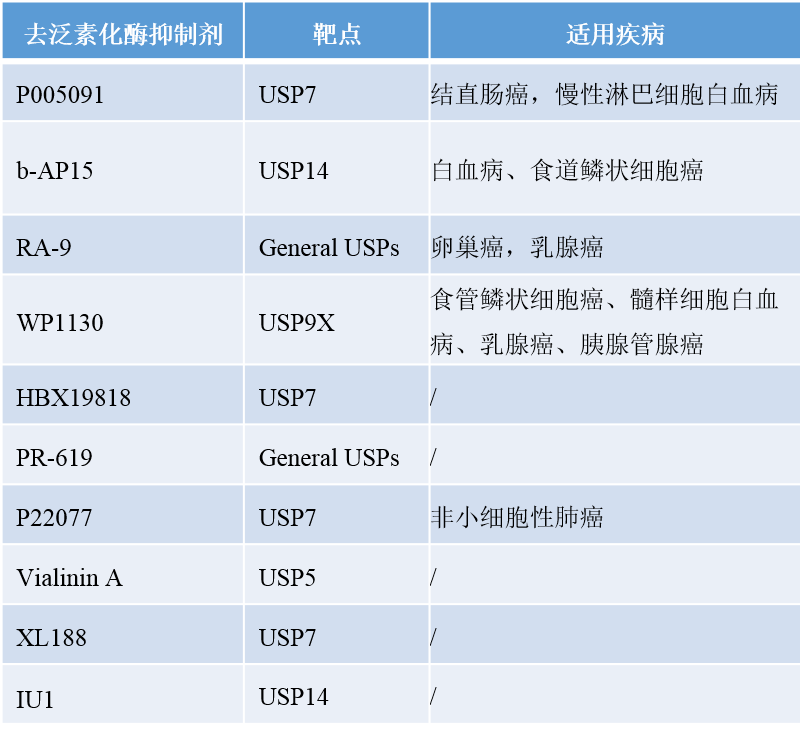
目前去泛素化酶的抑制剂主要以小分子化合物为主,并未有上市的去泛素化酶抑制剂药物。目前研究得最多的去泛素化酶抑制剂是USPs的抑制剂,因此,USPs已经成为新型药物作用的常见靶点(表1)。市面上常见的去泛素化酶抑制剂主要为P005091,b-AP15(CSN15845),P22077与IU1(CSN15814) [5]。其中,P005091能够选择性地抑制USP7的活性,而USP7的过度激活与结直肠癌、慢性淋巴细胞白血病都有一定的关系;P22077同样也是USP7的一种特异性抑制剂,但是其主要应用在非小细胞肺癌中;b-AP15是USP14的一种特异性抑制剂,其与食道鳞状细胞癌的发生密切相关;IU1是USP14的一种特异性抑制剂,研究证实, IU1可以抑制USP14的功能,使一些蛋白酶体底物的含量下降, 如tau蛋白[5-6]。下表总结归纳了一些常见的去泛素化酶抑制剂的作用靶点及适用疾病。
表1:去泛素化酶抑制剂[6]
目前已经发现去泛素化酶通过多条信号通路,如Wnt/β-catenin 信号通路、TGF-β 通路、PI3K/Akt 通路、NF-κB通路等调节肿瘤的生长及癌细胞的扩散,但目前并未有上市的去泛素化酶抑制剂药物。相信在未来, 随着去泛素化酶及相应抑制剂的发现, 靶向去泛素化酶治疗肿瘤有望成为现实。
CSNpharm作为一家全球领先的小分子化合物供应商,拥有多种去泛素化酶相关的抑制剂,可用于相关疾病的探索。此外,还有Ubiquitination Compound Library (CSN-L1019A),包含102个具有生物活性的化合物,靶向Proteasome, DUB, E3 Ligase, E1 Activating, E2conjugating等,可用于泛素化相关研究和高通量/高内涵筛选,是您科学研究的有利工具!
参考文献:
1.Lothrop, A. P. , Torres, M. P. , & Fuchs, S. M. . (2013). Deciphering post-translational modificationcodes. Febs Letters, 587.
2.Mevissen, T. , & Komander, D. (2017). Mechanisms of DeubiquitinaseSpecificity and Regulation. Annu Rev Biochem. 20(86):159-192.
3.Clague, M. J. , S Urbé, & Komander, D. (2019). Publisher correction:breaking the chains: deubiquitylating enzyme specificity begets function.Nature Reviews Molecular Cell Biology, 20(6):338-352.
4.MJ Clague, S Urbe, & D Komander. (2009).Breaking the chains: structure and function of the deubiquitinases. NatureReview, 10(8):550-563.
5.范广晗, 朱虹, 方倚正, & 何俏军. (2018). 去泛素化酶在肿瘤中的作用及其抑制剂相关研究进展. 药学学报.
6.Varca AC., Casalena D., Chan WC., & Buhrlage SJ.,(2021).Identification and validation of selective deubiquitinase inhibitors, (21), 00257-9.

