RNA剪接:中心法则的剪刀手
类型:技术文章 时间:2022-06-24
在维持生理活动的过程中,“DNA-RNA-蛋白质”的中心法则每时每刻都在上演,RNA是实现从DNA编码到蛋白表达的重要“中间人”。DNA如同剧本,RNA如同按照剧本拍出的影片片段,需要通过“剪接”才能上演完整的“生命大戏”。
RNA剪接是实现真核生物从DNA到蛋白质信息传递的关键一环,而其中的剪接体则是催化完成RNA剪接的“操纵者”。过去几十年里,这一核心基础研究进展缓慢。然而,在2015年,施一公团队在剪接体结构解析领域获重大突破——首次实现了剪接体结构的解析!并在2017年解析第一个人源剪接体结构,之后更是首次解析了次要剪接体高分辨率三维结构(图1)[1]。
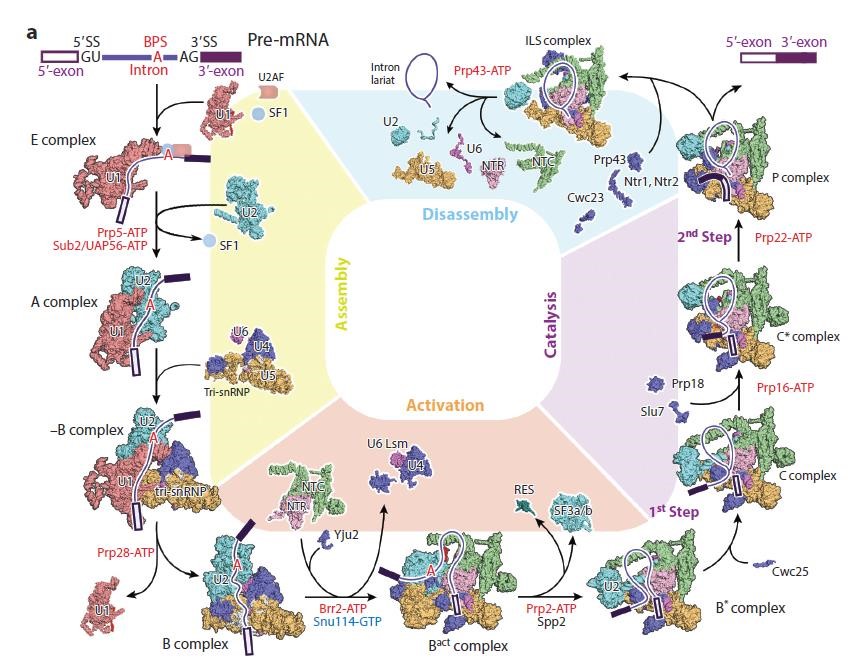
图1:施一公组解析的剪接体结构汇总[1]
RNA剪接
在所有类型的RNA中,能够翻译出蛋白的mRNA最被人所熟知,但mRNA并不能直接由DNA转录而成。在最初转录产物上,有着许多不参与编码蛋白的序列(即内含子),将参与编码蛋白的外显子分割开。而通过RNA剪接可以将内含子去除,并将外显子重新拼接起来。显然,其中两大主角是被剪接的pre-mRNA和行使剪接功能的RNA剪接复合体,其使命是将核不均一RNA(pre-mRNA)中的内含子剪切、除去,并将外显子有序连接,最终加工成成熟的mRNA(图2)[2]。
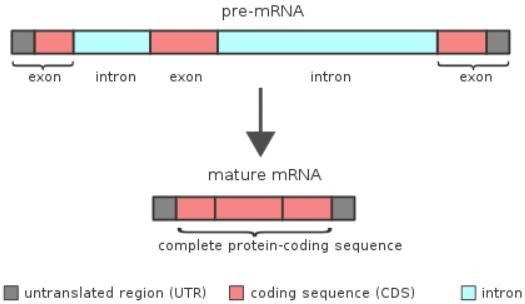
图2:从pre-mRNA到成熟mRNA[2]
RNA剪接过程
实现RNA剪接的主要组分为五个小核糖核蛋白(snRNP),包括U1、U2(下文提到的SF3B1是U2 snRNP的成员之一)、U4、U5 和 U6,负责切除大部分内含子。剪接过程包括组装、重排与催化。
组装——RNA剪接的第一步是U1 snRNP识别5'端剪接位点。当pre-mRNA中的顺式作用元件与各种反式作用因子相互作用时,U1首先通过其snRNA(核小RNA,是RNA剪接体的主要成分)的碱基配对识别5’端剪接位点。随后,U2 snRNP在U2 辅助因子(U2AF)的协助下,通过碱基互补配对的方式替换与分支位点结合形成A复合体。
重排——A复合体稳定形成后,三联snRNP颗粒(U4、U6、U5)加入,使A复合体发生重排,从而把3个剪接位点拉到一起。其中U4和U6 snRNP通过其RNA组分的互补配对相结合,而U5 snRNP通过蛋白质相互作用松散结合,这时形成B复合体。随后,U4/U5/U6 -snRNP通过构象重排,以形成活化的剪接体(B复合体)。其中,我们也可以看出,组装和重排的过程是相互穿插的,并不割裂。
催化——去除内含子区域,并通过两个连续的酯交换反应形成复合体C,从而连接外显子形成mRNA。在剪接催化完成时,剪接体组分和内含子套索从连接的外显子上解离。整个剪接过程中的snRNP被释放后会再次参与新的一次剪接体的组装、重排与催化。
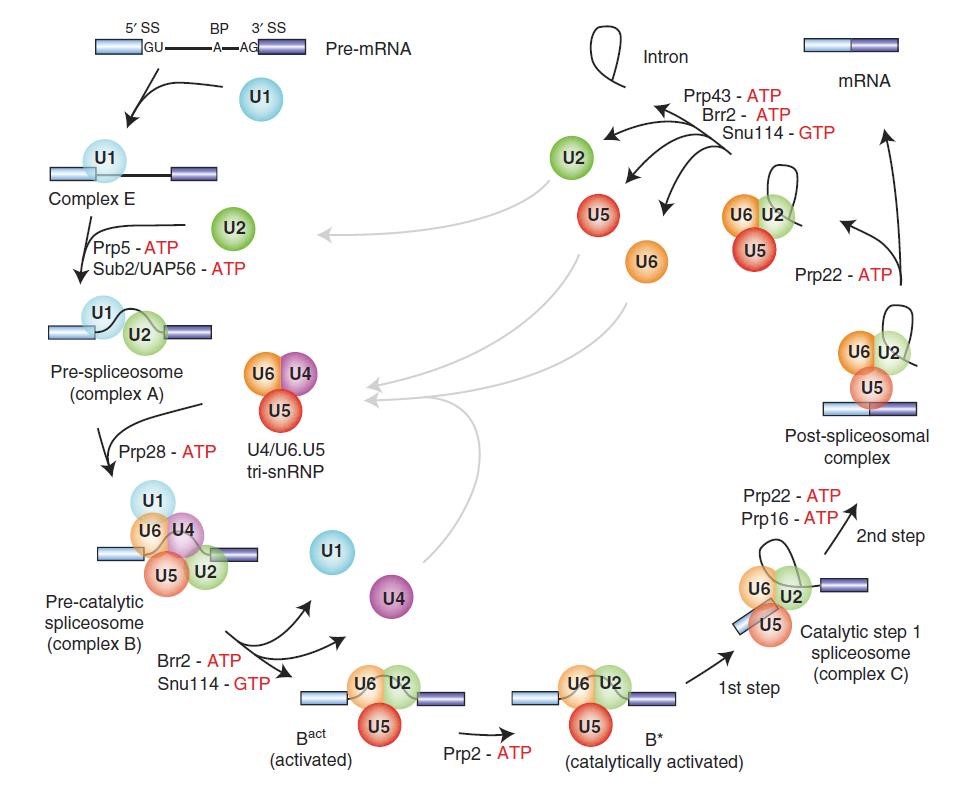
图3:RNA剪接过程[3]
RNA剪接体抑制剂
为了便于观察RNA剪接过程,各种剪接体抑制剂常会被用于实验。根据其作用机制的不同,剪接体抑制剂分为以下几类[4]:
1. 干扰剪接体组装:
1.1 干扰剪接体组装早期阶段,并使组装停滞在A复合体上:包括人工合成化合物Madrasin,以及三类天然产物:Isoginkgetin(CSN14005),Tetrocarcin A和Pladienolide B。这三类天然产物可以靶向U2 snRNP的组成成分SF3B1。
1.2 干扰剪接体组装的晚期阶段:包括Psoromic acid(CSN29496)和Naphthazarine等,这部分剪接体抑制剂对剪接体的影响是浓度依赖性的,当抑制剂浓度较低时主要干扰剪接体组装的晚期阶段,浓度升高时主要干扰早期阶段。
2. 靶向已知酶的活性:
2.1 三种组蛋白去乙酰化酶(HDAC)抑制剂:SAHA, Splitomicin(CSN12889)和Dihydrocoumarin(CSN10815),它们可以抑制体外RNA剪接,剪接体组装会停滞在B复合体。
2.2 三种组蛋白乙酰转移酶(HAT)抑制剂:Garcinol, AA和BA3,可以抑制体外RNA剪接。
2.3 蛋白磷酸酶PP1/PP2A抑制剂,包括Okadaic acid(CSN26242), Tautomycin和Microcystin-LR(CSN18914),能够抑制体外RNA剪接。
2.4 SR蛋白激酶抑制剂,包括NB-506和Chlorhexidine(CSN10615)等,能够影响细胞内RNA剪接并抑制SF2/ASF磷酸化。
3.抗生素:
有研究显示三种抗生素可作为剪接体抑制剂:Cl-tetracycline, Streptomycin(CSN11986) 和Erythromycin(CSN12503),前两者通过与pre-mRNA 非特异性结合对剪接产生间接影响, 而Erythromycin几乎可以完全抑制C复合体的形成[5]。
临床研究中的剪接体抑制剂见下表。
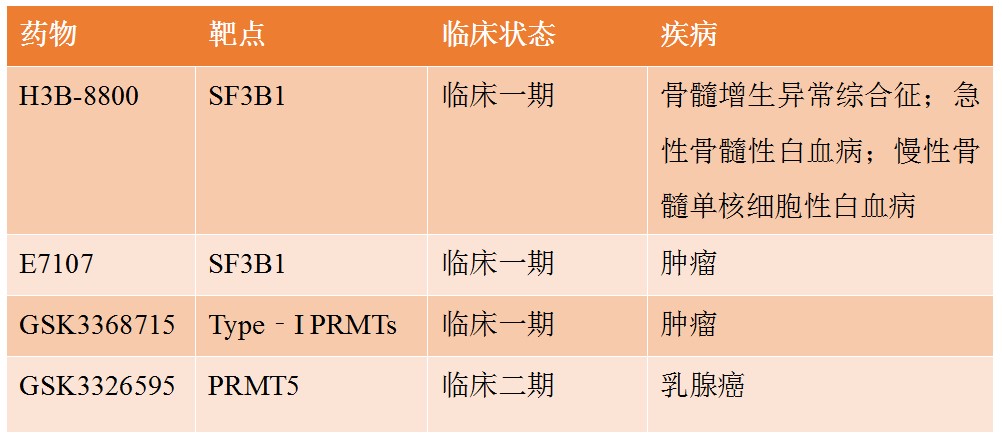
真核生物的RNA剪接是基因表达和功能调控的一个关键环节,在细胞分化以及疾病的发生发展过程中发挥不可忽视的作用。因此,剪接体抑制剂对基础研究大有帮助,一方面可以帮我们探寻RNA的剪接机制,另一方面又可以帮我们深入观察RNA剪接调控网络如何运作。由于剪接体在恶性肿瘤中发挥着至关重要的作用,剪接体抑制剂有潜力成为治疗癌症的重要“武器”[4]。
CSNpharm作为一家全球领先的小分子化合物供应商,拥有多种RNA剪接体抑制剂(https://www.csnpharm.cn/cellular/rna_splicing.html),可用于相关疾病的探索。此外,还有Natural Product Library (CSN-L1005A),包含了从植物或者其它生物中分离的1526个天然产物,用于高通量以及高内涵筛选,是发现新药物靶标的有利工具!
更多产品信息,请登录CSNpharm官网:
友情提示:CSNpharm产品仅用于科学研究!
参考文献:
1. Wan R, Bai R, Zhan X, Shi Y. How Is Precursor Messenger RNA Spliced by the Spliceosome? Annu Rev Biochem. 2020 Jun 20;89:333-358.
2. https://encyclopedia.thefreedictionary.com/Intron
3. Will CL, Lührmann R. Spliceosome structure and function. Cold Spring Harb Perspect Biol. 2011 Jul 1;3(7):a003707.
4. Effenberger KA, Urabe VK, Jurica MS. Modulating splicing with small molecular inhibitors of the spliceosome. Wiley Interdiscip Rev RNA. 2017 Mar;8(2):10.1002/wrna.1381.
5. Hertweck M, Hiller R, Mueller MW. Inhibition of nuclear pre-mRNA splicing by antibiotics in vitro. Eur J Biochem. 2002 Jan;269(1):175-83. doi: 10.1046/j.0014-2956.2001.02636.x. PMID: 11784311.
6. Taylor J , Lee S C . Mutations in spliceosome genes and therapeutic opportunities in myeloid malignancies[J]. Genes Chromosomes and Cancer, 2019, 58(12).
7. https://clinicaltrials.gov/ct2/home
