DNMT: 表观遗传中的“搬运工”
类型:技术文章 时间:2022-02-24
DNA甲基化是生物体重要的表观遗传学修饰方式之一,是在DNA甲基转移酶(DNMT)的催化下进行的。DNMT具有多种调控功能,参与机体发育过程中干细胞生长、细胞增殖、器官发育、衰老和肿瘤发生等多个生物学过程。因此,DNMT也成为肿瘤等疾病药物治疗的理想靶点。
经典遗传学认为,基因序列的改变必将引起生物体的改变。但是随着研究的不断深入,科学家发现了一些无法用经典遗传学来解释的现象:同卵双生的两个人具有完全相同的基因组,在同样的环境中长大,但其性格或健康等出现较大差异;又如马、驴正反交的后代差别较大(马骡和驴骡)。这就提示我们,在DNA序列之外存在更高的遗传信息,这便是表观遗传。其中,DNA的甲基化便是其中重要的一种。许多关键的生理过程都会有DNA甲基化的参与,如细胞生长发育、基因损伤的修复与基因突变等。而DNMT便是参与DNA甲基化的关键酶。
DNMT
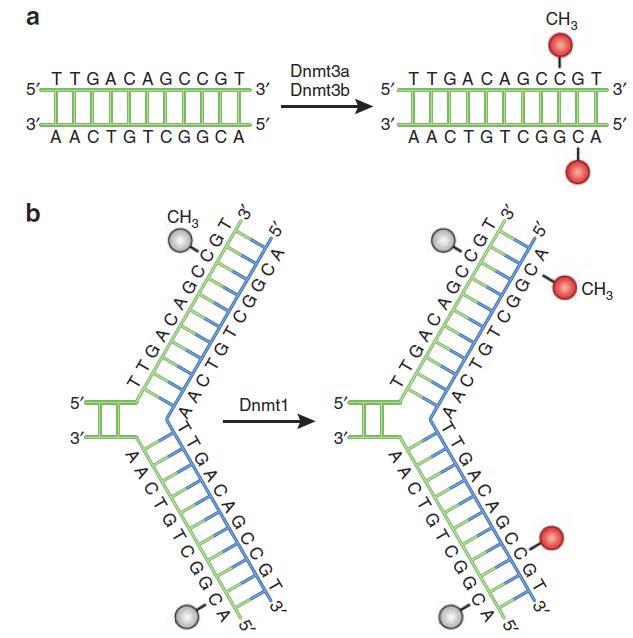
图1:DNA甲基化[1]
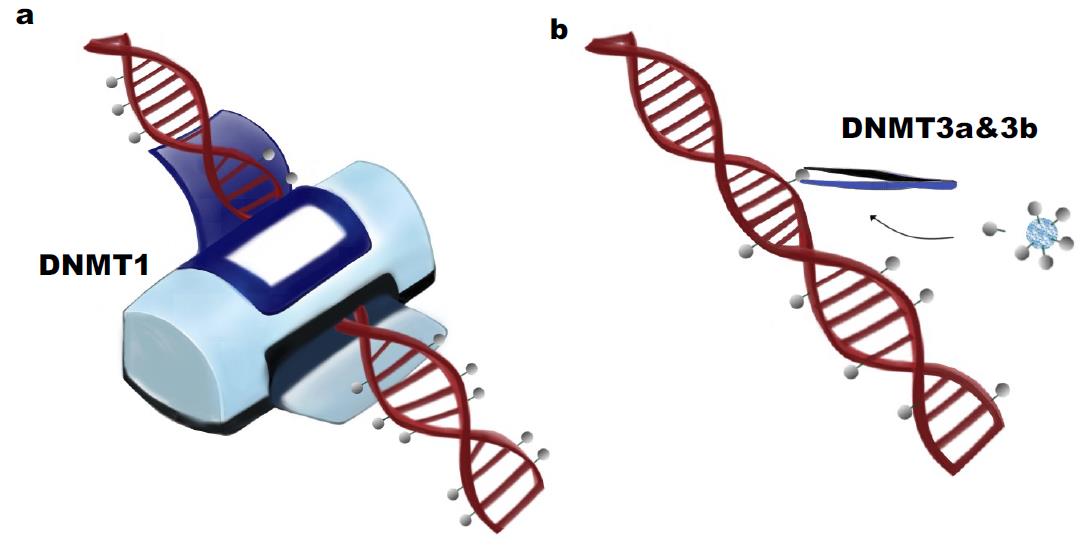
DNMT作用机制
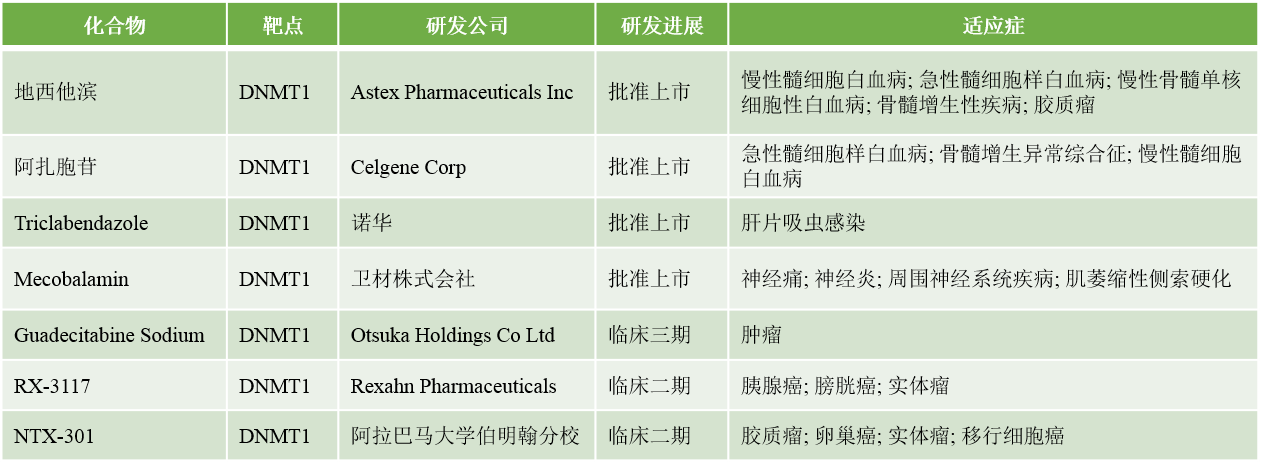
DNMT抑制剂
表1: 已经上市或临床研究中的DNMT抑制剂(数据来源: 药渡)
DNA甲基化为癌症治疗提供了一个新的靶点。作为表观基因药物之一,DNMT抑制剂在抗肿瘤方面的作用受到广泛重视。由于核苷类DNMT抑制剂对细胞的DNA具有破坏作用,其细胞毒作用较大[6],而非共价结合的非核苷类DNMT抑制剂特异性较高,能直接阻断DNMT的活性部位,从而避免了对细胞DNA的破坏,故目前人们的研究重点已转向开发非核苷类DNMT抑制剂。进一步开发疗效好、毒副作用更小的非核苷类DNMT抑制剂可能是今后的研究方向。
CSNpharm作为一家全球领先的小分子化合物供应商,拥有DNMT抑制剂,可用于表观遗传机制及相关疾病治疗机制研究。此外,还有Epigenetics Compound Library(CSN-L1008A),包含537个化合物,靶向作用于表观遗传学通路的相关蛋白,例如HDACs, HATs, DNMTs等,是研究表观遗传学在生物学和疾病中的作用绝佳工具!
友情提示:CSNpharm产品仅用于科学研究!
参考文献:
1.Moore LD, Le T, Fan G. DNA methylation and its basic function.Neuropsychopharmacology. 2013 Jan;38(1):23-38.
2.Lyko F. The DNA methyltransferase family: aversatile toolkit for epigenetic regulation. Nat Rev Genet. 2018Feb;19(2):81-92.
3.Cui D, Xu X. DNA Methyltransferases, DNA Methylation, and Age-AssociatedCognitive Function. Int J Mol Sci. 2018 Apr 28;19(5):1315.
4.姜雯雯, 熊志伟, 朱芳芳,等. DNA甲基转移酶功能及活性研究进展[J]. 生物化工, 2017, 000(002):93-95.
5.杨雷, 薛晓文, 张奕华. DNA甲基转移酶抑制剂的研究进展[J]. 药学与临床研究, 2009, 17(004):323-327.
6.Jüttermann R, Li E, Jaenisch R. Toxicity of 5-aza-2'-deoxycytidine tomammalian cells is mediated primarily by covalent trapping of DNAmethyltransferase rather than DNA demethylation. Proc Natl Acad Sci U S A. 1994Dec 6;91(25):11797-801.

